Mounjaro: Patienten melden „mechanischen Defekt“
Im August vergangenen Jahres hatte Lilly Anwendungshinweise zu Mounjaro (Tirzepatid) geliefert. Dabei wurde auf die korrekte Entlüftung und die Überfüllung des Kwikpens hingewiesen. Dennoch meldeten Patient:innen eine Blockade des Fertigpens.
Mounjaro enthält den GIP/GLP-1-Rezeptor-Agonisten Tirzepatid. Dieser aktiviert GLP1- und GIP-Rezeptoren gleichzeitig und sorgt somit für eine Senkung des Blutzuckerspiegels sowie des Appetits. Das Arzneimittel ist zugelassen zur Behandlung von Typ-2-Diabetes sowie zum Gewichtsmanagement.
Seit Mitte Mai steht Mounjaro als Kwikpen in verschiedenen Wirkstärken zur Verfügung. Zuvor war das Arzneimittel ausschließlich als Durchstechflasche erhältlich. Jeder Pen enthält jeweils vier Dosen, die einmal wöchentlich appliziert werden. Dafür ist jeweils eine neue Pen-Nadel erforderlich, um ein Verstopfen der Kanüle und das Eindringen von Luft in den Pen zu vermeiden.
Doch die Nadeln liegen den Packungen nicht bei. Dies könne dazu führen, dass Patient:innen die Kanülen nicht bei jeder Anwendung wechseln und den Pen mit aufgesetzter Kanüle lagerten, so die Arzneimittelkommission der Deutschen Apotheker (AMK). Dies führe dazu, dass Luft leichter in den Pen gelangen kann. Die Folge: Eine erschwerte Entnahme und Begünstigung der vorzeitigen Arretierung des Pens.
Entlüften
Vor der Anwendung sollte der Pen entlüftet werden. Dies ist insgesamt bis zu achtmal möglich. Werden mehr Entlüftungsschritte durchgeführt und übermäßig entlüftet, besteht die Gefahr, dass der Pen vorzeitig arretiert und die Applikation weiterer Dosen nicht möglich ist.
Von Mai bis September 2024 hat die AMK 149 Meldungen zu Verdachtsfällen eines Qualitätsmangels bei Mounjaro-Kwikpen erhalten, alle mit dem Fehlerbild „mechanischer Defekt“. Das Problem: Der Pen blockiert bei der Entnahme der vierten oder bereits der dritten Dosis. Außerdem lasse sich das Dosierrad nicht mehr einstellen.
Überfüllung
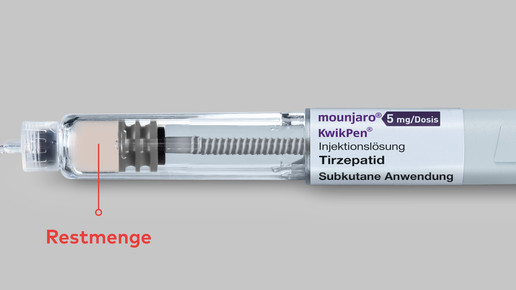
Nach der Entnahme der vierten Dosis bleibt eine Restmenge zurück. Bei den Patient:innen könne dies den Eindruck erwecken, dass noch eine Dosis aus dem Pen entnommen werden könne.
Anwendungsfehler
Laut AMK führt der Hersteller die Meldungen auf Anwendungsfehler zurück. Deren Ursache könnten die Beschaffenheit des Kwikpens sowie das „unübliche“ Dosierungsintervall sein. Im Laufe der Anwendung könne sich das Risiko erhöhen, dass bei den Patient:innen Unklarheit über die Anzahl der verabreichten Dosen bestehe und in der Folge versucht werde, nach der vierten Dosis eine weitere entnehmen zu wollen. In diesem Zusammenhang wird auf den in der Gebrauchsinformation enthaltenen Arzneimittelkalender zur Dokumentation der verabreichten Dosen verwiesen.
Kein herstellerbedingtes Qualitätsproblem – aber
Die AMK ging den Meldungen auf den Grund und beauftragte das Zentrallaboratorium Deutscher Apotheker (ZL) mit der Untersuchung von Reklamations- und Vergleichsmustern. Das Ergebnis: Alle Pens lösten viermal aus und es blieb ein vergleichbares Restvolumen zurück. „Somit konnte kein herstellerbedingtes Qualitätsproblem erkannt werden.“ Dies weise auf Anwendungsfehler hin.
Aufgrund der gehäuften gleichen Fehlermeldungen wird der Hersteller in die Pflicht genommen. Die AMK erkennt „herstellerseitige Faktoren, die potenziell das Auftreten von Medikationsfehlern (hier Anwendungsfehler) bedingen können“ und fordert Anpassungen der Produkteigenschaften.
- Dokumentationshilfe: Eine schriftliche Dokumentation der verabreichten wöchentlichen Dosen ist nötig, allerdings ist der in der Gebrauchsinformation enthaltene Arzneimittelkalender nicht prominent platziert und könnte leicht übersehen werden. Die Empfehlung der AMK: den Kalender separat beilegen oder eine Dokumentation auf der Primär- oder Sekundärverpackung zu ermöglichen.
- Skalierung und Restvolumen: Die Restmenge nach Entnahme der vierten Dosis kann bei Patient:innen zu Irritationen führen. Eine unmissverständliche, numerische Skalierung auf dem Penkörper würde Abhilfe schaffen.
- Kanülen: Der Packung liegen keine Kanülen bei. Das sollte sich ändern und die notwendige Anzahl an Kanülen konfektioniert werden.
- Temperaturhinweis: In der Gebrauchsinformation sind zwar Hinweise zur korrekten Lagerung des Pens enthalten, allerdings fehlt der Hinweis, ob der Pen vor der Anwendung auf Raumtemperatur gebracht werden muss. Die AMK regt zur Anpassung an, denn werde der Pen nicht vor der Anwendung nach Entnahme aus dem Kühlschrank auf Raumtemperatur gebracht, kann das übermäßige Entlüften begünstigt werden, da die Patrone einen leichten Unterdruck aufweist, der nach Aufsetzen einer Kanüle und im Zuge des Druckausgleichs das Einziehen von Luft begünstigt.
- Patientenschulung: Weil davon auszugehen ist, dass Patient:innen – insbesondere diejenigen, die das Arzneimittel zum Gewichtsmanagement anwenden – einen besonderen Schulungsbedarf haben, sollte herstellerseitig behördlich abgestimmtem Schulungsmaterial wie Patientenkarten oder Anwendungsvideos geliefert werden.
Apotheken werden gebeten, Patient:innen bei der Abgabe des Arzneimittels über die korrekte Handhabung zu informieren. „Eine sichere Arzneimitteltherapie hängt entscheidend von der richtigen Handhabung des Arzneimittels ab. Besonders bei komplexen Anwendungen, wie z. B. von Pens, ist eine Beratung in der Apotheke vor Ort unverzichtbar, um Anwendungsfehler zu vermeiden“, so der AMK-Vorsitzender Prof. Dr. Martin Schulz.