Urtikaria: Nächste Indikation für Kassenschlager Dupixent? Katharina Brand, 19.09.2024 13:53 Uhr
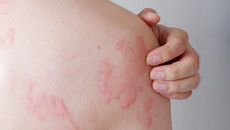
Quaddeln, Angioödeme und Juckreiz sind die Hauptsymptome der chronisch-spontanen Urtikaria, kurz CSU. Sanofi hat nun die Ergebnisse der bestätigenden Phase-3-Studie zu Dupixent (Dupilumab) vorgelegt.
Dupilumab, entwickelt von Sanofi in Zusammenarbeit mit Regeneron, ist bereits für Asthma und COPD, atopischer Dermatitis und chronische Sinusitis mit Nasenpolypen zugelassen. Im vergangenen Jahr erzielte Sanofi mit dem Präparat Einnahmen von 10,7 Milliarden Euro, was einer Umsatzsteigerung von knapp 30 Prozent entspricht.
Die Phase-3-Studie Liberty-Cupid C bestätigte sowohl die primären als auch die wichtigen sekundären Endpunkte bei der Behandlung von Patienten mit unkontrollierter, biologisch-naiver chronischer spontaner Urtikaria, die zusätzlich eine Antihistaminikum-Therapie erhielten. Diese Hauterkrankung, gekennzeichnet durch plötzlich auftretende Quaddeln und anhaltenden Juckreiz, beeinträchtigt die Lebensqualität erheblich.
Die Ergebnisse dieser Studie bestätigen die Ergebnisse der ersten Phase-3-Studien zu Dupixent. Japan war Anfang des Jahres das erste Land, das das Medikament für Erwachsene und Jugendliche mit dieser Erkrankung genehmigte und auf den Markt brachte.
Signifikante Wirksamkeit
In Studie C nahmen 151 Teilnehmer, darunter Kinder und Erwachsene, teil. 74 Personen erhielten randomisiert das Medikament, 77 das Placebo zusammen mit einem H1-Antihistaminikum. Nach 24 Wochen zeigte sich eine signifikante Wirksamkeit im Vergleich zum Placebo: Der Juckreiz verringerte sich um 8,64 Punkte unter dem Medikament gegenüber 6,10 Punkten bei Placebo. Auch die Schwere der Erkrankung – Juckreiz und Nesselsucht – nahm um 15,86 Punkte ab, während sie bei Placebo um 11,21 Punkte zurückging. Zudem erreichten 30 Prozent der Patient:innen unter dem Medikament eine vollständige Remission, verglichen mit 18 Prozent der Placebo-Gruppe.
Die Sicherheitsdaten entsprechen im Wesentlichen dem bekannten Profil. Die Rate an behandlungsbedingten unerwünschten Ereignissen lag bei beiden Gruppen jeweils bei 53 Prozent. Allerdings traten spezifische unerwünschte Ereignisse häufiger auf: Injektionsstellenreaktionen wurden bei 12 Prozent der Patienten unter dem Medikament beobachtet, verglichen mit 4 Prozent in der Placebo-Gruppe, versehentliche Überdosierungen traten bei 7 Prozent der Patienten auf, während sie bei 3 Prozent der Placebo-Gruppe vorkamen, und Covid-19-Infektionen wurden bei 8 Prozent der Patienten unter dem Medikament festgestellt, im Vergleich zu 5 Prozent bei denen, die Placebo erhielten.
Die Ergebnisse werden der FDA für den ergänzenden Biologika-Antrag vorgelegt und sollen auf einem bevorstehenden medizinischen Kongress präsentiert werden.
Vorangegangene Studien
Die Liberty-Cupid-A-Studie und die Liberty-Cupid-B-Studie untersuchten die Wirksamkeit und Sicherheit des Medikaments bei dieser Hauterkrankung in spezifischen Patientengruppen. Die Cupid-A-Studie richtete sich an Erwachsene und Jugendliche ab 12 Jahren, die unzureichend auf Antihistaminika angesprochen hatten. Sie zeigte signifikante Verbesserungen der Symptome, einschließlich einer stärkeren Reduktion des Juckreizes und einer höheren Rate vollständiger Remissionen im Vergleich zu Placebo.
Die Cupid-B-Studie konzentrierte sich auf Erwachsene, die ebenfalls nicht ausreichend auf Antihistaminika reagierten. Auch hier wurden signifikante Vorteile gegenüber Placebo festgestellt, mit ähnlichen positiven Effekten auf die Symptome. Beide Studien bestätigten die Sicherheit des Medikaments und unterstützen seine Anwendung in beiden untersuchten Patientengruppen.