Keine Ausnahmegenehmigung für Amoxicillin-Import
Lieferengpässe bei Arzneimitteln bleiben ein Dauerproblem in Deutschland. Auch dieses Jahr fehlen erneut wichtige Medikamente. Um den Engpässen entgegenzuwirken, können die zuständigen Landesbehörden eine Genehmigung erteilen, bestimmte Arzneimittel vereinfacht aus dem Ausland zu importieren.
MVS Pharma, ein Unternehmen aus Baden-Württemberg mit einer Niederlassung in Indien, plante eigentlich, Amoxicillin aus Indien zu importieren, um den Bedarf in Deutschland zu decken.
Doch das Regierungspräsidium Stuttgart (RP) lehnte den Antrag ab. Dagegen möchte der Pharma-Konzern nun Klage einreichen. Laut Rainer Proksch, dem Geschäftsführer von MSV Pharma, erfülle das Unternehmen nämlich alle Voraussetzungen für eine Einzelgestattung nach § 79 Abs. 5 Arzneimittelgesetz (AMG) sowie den Vorgaben der Allgemeinverfügung vom 9. Mai 2023, die bis April 2025 verlängert wurde, um das Medikament einzuführen.
In § 79 wird die Ausnahmeermächtigung für Krisenzeiten geregelt. Hiernach dürfen im Falle eines Versorgungsmangels im Einzellfall Medikamente in Deutschland in Verkehr gebracht werden, die normalerweise nicht zugelassen sind, wenn die notwendige Versorgung der Bevölkerung mit Arzneimitteln sonst ernstlich gefährdet wäre. Nach Ansichten von MSV Pharma ist das bei dem Antibiotikum ganz klar der Fall.
Einfuhrerlaubnis aus Drittstaaten
Auf Anfrage der Redaktion erklärt das RP: „Bei vorliegendem Fall handelt es sich um ein laufendes Verfahren – daher können wir im Konkreten dazu leider keine Angaben machen.“ Allerdings gab eine Sprecherin Auskunft über das grundsätzliche Vorgehen. Im Gegensatz zu MSV Pharma ist das RP der Auffassung, dass § 79 AMG zur Ausnahmeermächtigung nicht die Einfuhrerlaubnis nach § 72 AMG außer Kraft setze.
Demnach dürfen nur Arzneimittel aus EU-Staaten und Mitgliedsstaaten des Europäischen Wirtschaftsraumes ohne akribische Qualitätsprüfung importiert werden. Der Grund: Im EU-Raum werden Arzneimittel einheitlich nach GMP-Standards hergestellt. Hier bestehen keine Bedenken bei einer Einfuhr, erklärt das RP.
Das gilt nicht bei der Einfuhr aus Drittstaaten. „Einfuhren aus Drittstaaten bedürfen daher praktisch immer einer Einfuhrerlaubnis, vor deren Erteilung unter anderem auch durch eine Inspektion des Herstellungsbetriebes durch hiesige Inspektoren geprüft wird, ob die hiesigen hohen GMP-Standards dort eingehalten werden“, erklärt die Sprecherin. Zudem müsse ein hiesiger pharmazeutischer Unternehmer die eingeführten Arzneimittel erstmalig in den Verkehr bringen.
Dem Nutzen einer Versorgung von Patienten mit vorübergehend knappen Arzneimitteln stehe dabei das erhebliche Risiko einer Einfuhr und Abgabe von Arzneimitteln, deren ordnungsgemäße Qualität nicht mit hinreichender Sicherheit festgestellt wurde, gegenüber.
„Wir weisen in diesem Zusammenhang auch noch darauf hin, dass das Bundesinstitut für Arzneimittel und Medizinprodukte in Bonn vor wenigen Tagen festgestellt hat, dass eine Analyse der vorliegenden Daten zu Beständen und zur geplanten Produktion von Antibiotikasäften ergibt, dass bei fast allen Antibiotika (auch mit dem Wirkstoff Amoxicillin) mit einer Versorgung zu rechnen ist, die den prognostizierten Bedarf mindestens deckt oder sogar übersteigt“, so die Sprecherin.
Einfuhr im öffentlichen Interesse
Die Einschätzung des RP, eine zusätzliche Importerlaubnis nach § 72 AMG zu fordern, hält Proksch für „ermessensfehlerhaft und sachfremd“. Schließlich liege die Einfuhr des Antibiotikums im öffentlichen Interesse. Die Qualität der Arzneimittel sei durch eine internationale GMP-konforme Herstellung und einem zusätzlichen EU-Retest in einem europäischen Labor sichergestellt, betont das Unternehmen. „Auf die konkreten von uns zur Verfügung gestellten Unterlagen sowie die qualitative Prüfung des Arzneimittels in der EU nach den Vorgaben der AMWHV (Arzneimittel- und Wirkstoffherstellungsverordnung) geht das RP in ihrem Ablehnungsbescheid nicht ein“, kritisiert Proksch.
Qualitätsstandards auch in der Anwendung
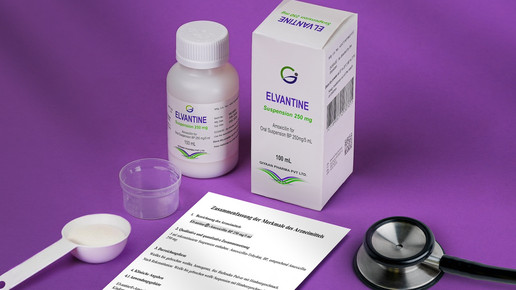
„Wir verstehen neben den Qualitätsanforderungen zum Produkt selbst auch Qualitätssicherung des Produkts und dem Umgang mit Patienten, dass ein sicherer Umgang und Verwendung des Arzneimittels sichergestellt wird und dieser sich eindeutig und einfach an die Bestimmungen der Verwendung dieses Arzneimittels richten kann“, erklärt Proksch. Arzneimittelsicherheit müsse nicht nur beim Produkt bestehen, sondern auch die Anwendung müsse eindeutig für einen Laien erkennbar und anwendbar sein. „Was nützt das perfekte Produkt, wenn es falsch angewendet wird.“
Dazu gehörten für MVS Pharma auch ein Messbecher ebenso wie ein deutscher Beipackzettel und die Möglichkeit einer einfachen Abrechnung durch die Apotheken. „Hier hinken die aktuellen Allgemeinverfügungen und pseudo erstellten Importerleichterungen stark hinterher, beziehungsweise gehen gar nicht darauf ein“, so Proksch.
lesen Sie weiter.