Valsartan: Da waren‘s nur noch 3
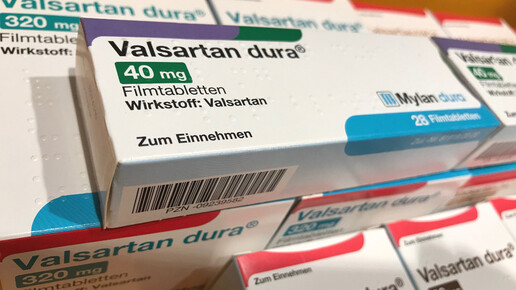
Erst NDMA, dann NDEA: Die Verunsicherung bei Valsartan ist zurück. Im Juli wurden mit N-Nitrosodimethylamin (NDMA) verunreinigte Valsartan-haltige Arzneimittel zurückgerufen. Mehr als ein Dutzend Hersteller waren betroffen. Kurz darauf wurde N-Nitrosodiethyldiamin (NDEA) in einigen Präparaten nachgewiesen. Und auch Irbesartan stand plötzlich auf der Rückrufliste. Am Freitag die nächste Hiobsbotschaft – das sicher geglaubte Valsartan dura enthält womöglich NDEA und musste zurück. Die Versorgung der Patienten stemmen nur noch wenige Hersteller. TAD ist einer von ihnen.
Novartis, Puren/Aurobindo und TAD sind die verbliebenen Unternehmen, deren Valsartan-haltigen Arzneimittel nicht mit einem Nitrosamin verunreinigt sind. Eine Charge Valsartan/Hydrochlorothiazid 320/25 mg musste Aurobindo im Sommer zurückrufen, weil der Wirkstoff ausnahmsweise vom chinesischen Ersatzwirkstofflieferanten Zhejiang Tianyu eingekauft worden war. Die Substanz aus eigener Synthese gilt dagegen nach wie vor als sicher.
Auch Novartis und TAD produzieren Valsartan selbst. Der Originalhersteller fertigt die Substanz in Irland und der Schweiz – im Unterschied übrigens zur Generikatochter Sandoz/Hexal/1A. Die Kassen hatten im Sommer die Mehrkosten ausnahmsweise übernommen; eine dauerhafte Lösung wird das Originalprodukt wahrscheinlich aber nicht werden.
Bleibt neben Puren/Aurobindo also noch TAD. Der Generikahersteller aus Cuxhaven gehört zu Krka mit Sitz im slowenischen Novo mesto und hat an die Apotheker erneut ein Schreiben verschickt, das Sorge und Verunsicherung nehmen und für das eigene Produkt werben soll. Darin teilt das Unternehmen mit, den Wirkstoff Valsartan nicht von den chinesischen Lohnherstellern Zhejiang Huahai Pharmaceuticals und Zhejiang Tianyu Pharmaceuticals zu beziehen und somit nicht von den Verunreinigungen NDMA und NDEA betroffen zu sein. Aus Sicherheitsgründen habe man „neben Valsartan auch alle anderen sartanhaltigen Arzneimittel auf diese Verunreinigungen überprüfen lassen.“ Der Konzern kann bestätigen, „dass auch diese frei von NDMA und NDEA sind“.
Als Mitglied der Krka-Gruppe habe TAD Zugriff auf die eigenen Produktionsstätten innerhalb der EU. „Alle Produktionsprozesse unterliegen strengen EU-GMP-Normen für Arzneimittel“, ist in dem Schreiben zu lesen. Der Wirkstoff werde auf Basis eines von Krka selbstentwickelten und durch europäische Patente bestätigten Verfahrens synthetisiert und kontrolliert. „Wir haben unsere Produktion bereits seit Juli enorm gesteigert und tun dies natürlich jetzt auch weiterhin. Wir werden alle Möglichkeiten nutzen, um unsere Kapazitäten zu erhöhen und somit die Versorgung der deutschen Valsartan-Patienten so gut es geht sicherzustellen“, teilt ein TAD-Sprecher mit.
Mylan hatte am Freitag alle im Umlauf befindlichen Chargen und Packungsgrößen Valsartan dura zu 40, 80, 160 und 320 mg sowie die Kombination Valsartan/HCT zu 80/ 12,5 mg, 160/ 12,5 mg, 320 /12,5mg, 160/ 25 mg und 320/ 25mg zurückgerufen. In der aktiven Substanz aus den Laboratorien des Generikakonzerns in Indien wurde das Nitrosamin NDEA in Spuren nachgewiesen. Der Rückruf erfolge als Vorsichtsmaßnahme im Einvernehmen mit der zuständigen Behörde.
Die Schweizer Arzneimittelbehörde Swissmedic hatte Valsartan-haltige Arzneimittel untersucht, die in der Schweiz auf dem Markt sind, und das Nitrosamin in einem Präparat von Mepha entdeckt. Drei Chargen mussten zurück. Der zu Teva gehörende Hersteller hatte die aktive Substanz aus der indischen Produktionsstätte von Mylan bezogen. Im Anschluss wurden die anderen Arzneimittelbehörden informiert.
Im Juli hatte Mylan noch bestätigt, dass die aktive Substanz Valsartan und die Fertigarzneimittel unterhalb der für NDMA erforderlichen Grenzwerte getestet wurden. NDMA ist das erste im Valsartan gefundene Nitrosamin. Noch im August wurde die Produktion hochgefahren und die Preise angezogen.





























APOTHEKE ADHOC Debatte