Emend bekommt Konkurrenz
Die US-Arzneimittelbehörde FDA hat ein neues Medikament zur Behandlung von Übelkeit und Erbrechen im Zusammenhang mit einer Chemotherapie zugelassen: Varubi enthält den Wirkstoff Rolapitant, der wie Aprepitant und Fosaprepitant ein Antagonist des Neurokinin-Rezeptors NK1 ist.
Varubi ist zugelassen zur Vorbeugung von verzögerter Übelkeit und Erbrechen infolge einer Chemotherapie. Die Tabletten sollen in Kombination mit anderen Antiemetika gegeben werden: 180 mg ein bis zwei Stunden vor Beginn der Chemotherapie.
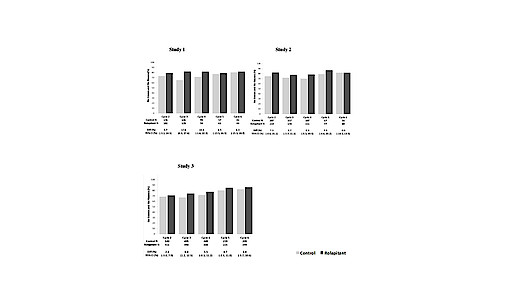
Der Hersteller Tesaro hatte drei Studien vorgelegt, in denen die Kombination von Rolapitant/Granisetron/Dexamethason mit Placebo/Granisetron/Dexamethason verglichen wurde. Die 2800 Patienten erhielten eine hoch emetogenen Chemotherapie (Cisplatin oder Anthrazyklin/Cyclophosphonamid) oder eine moderat emetogenen Chemotherapie.
In der Verumgruppe kam es seltener zu Erbrechen, auch Notfallmedikamente mussten seltener gegeben werden. Der Vorteil lag je nach Studie und Zyklus bei 0 bis 17 Prozentpunkten. Zu den häufigsten Nebenwirkungen zählen Neutropenie, Schluckauf, Appetitlosigkeit sowie Schwindel. Rolapitant hemmt außerdem CYP2D6, sodass das Neuroleptikum Thioridazin nicht parallel eingenommen werden darf. Die Bioäquivalenz zwischen intravenöser und oraler Applikation wurde in einer Studie mit 120 gesunden Probanden nachgewiesen.
Die chemotherapie-induzierte Übelkeit kann nicht nur zu physischen Problemen wie Dehydratation, Mangelernährung und Gewichtsverlust führen, sondern auch die Therapie gefährden. Der Komplex wird in zwei Phasen eingeteilt: Die akute Reaktion innerhalb der ersten 24 Stunden wird über Serotonin-Rezeptoren vom 5-HT3-Typ vermittelt; hier werden Setrone zur Behandlung eingesetzt. Bei der Spätphase, die bis zu 120 Stunden nach Therapiebeginn anhalten kann, spielen NK1-Rezeptoren eine Rolle: Durch die Bindung von Substanz P an den Rezeptor auf Zellen im Brechzentrum wird der Brechreiz ausgelöst.
Laut Tesaro wird die Spätreaktion unterschätzt: Während jeweils rund 35 Prozent der Patienten und Ärzte über Übelkeit in der Akutphase berichten, gibt es in der Spätphase eine erhebliche Diskrepanz: Nur 24 Prozent der Ärzte, aber 52 Prozent der Patienten berichten über entsprechende Symptome. Erbrechen tritt in der Akutphase nach Angaben von 17 Prozent der Ärzte und 13 Prozent der Patienten auf; in der Spätphase sehen 15 Prozent der Ärzte das Problem, aber 28 Prozent der Patienten.
Dies deckt sich mit den Ergebnissen der Studien: Zwischen 30 und 53 Prozent der Patienten erhielten ein Notfallmedikament in der Spätphase oder mussten sich übergeben. Tesaro sieht eine erhebliche therapeutische Lücke und rechnet bei Kosten von 300 (i.v.) beziehungsweise 450 (oral) US-Dollar je Dosis mit möglichen Umsätzen von bis zu 1,2 Milliarden Dollar.
In ähnlicher Indikation ist hierzulande seit 2003 Emend zugelassen: Das Präparat des Herstellers MSD Sharp & Dohme wird eingesetzt zur Prävention akuter und verzögerter Übelkeit und Erbrechen bei hoch emetogener, auf Cisplatin basierender Chemotherapie sowie zur Prävention von Übelkeit und Erbrechen bei moderat emetogener Chemotherapie, jeweils bei Erwachsenen.
Eine Stunde vor Beginn der Chemotherapie werden in Kombination mit einem Kortikosteroid und 5-HT3-Antagonisten 125 mg oral gegeben; an den Tagen 2 und 3 jeweils 80 mg. Alternativ kann das Schwesterprodukt Ivemend gegeben werden, das als Prodrug Fosaprepitant enthält. 150 mg werden als Infusion i.v. über 20 bis 30 Minuten gegeben, ebenfalls in entsprechender Kombination.
Aprepitant ist ein Hemmer von CYP3A4; entsprechend gibt es zahlreiche Interaktionen und Kontraindikationen, etwa mit Ciclosporin, Tacrolimus, Sirolimus, Everolimus, Alfentanil, Dihydroergotamin, Ergotamin, Fentanyl und Chinidin.
Laut Arzneiverordnungsreport gab es 2013 160.000 Emend-Verordnungen im Wert von 12 Millionen Euro. Ivemend spielt eine untergeordnete Rolle. Mit 460.000 Tagestherapiedosen (DDD) liegt Emend gleichauf mit Vergentan (Alizaprid). Der Dopaminantagonist ist ebenfalls zugelassen zur Prävention und Therapie von Übelkeit und im Zusammenhang mit einer Zytostatikatherapie oder Bestrahlung.
Ondansetron kommt demnach auf eine Million DDD, Granisetron auf 410.000 DDD, Palonosetron auf 110.000 DDD, Ivemend auf 50.000 DDD. Die generell gegen Übelkeit und Erbrechen unterschiedlicher Genese zugelassenen H1-Antihistaminika wie Dimenhydrinat, Diphenhydramin, Flunarizin und Cinnarizin summieren sich auf 16,3 Millionen DDD, das Histaminanalogon Betahistin auf 55,6 Millionen DDD. Der Muscarinantagonist Scopolamin kommt als TTS auf 34.000 DDD. Diese Präparate werden auch unabhängig von der Krebstherapie eingesetzt.
Das Patent für Emend läuft bis 2019, der MSD-Mutterkonzern Merck machte mit Emend 2013 mehr als 500 Millionen Dollar Umsatz. In den USA läuft ein Patentstreit mit der Fresenius-Tochter Kabi.