49 neue Wirkstoffe auf dem Markt APOTHEKE ADHOC, 19.12.2014 09:43 Uhr
49 Medikamente, die in diesem Jahr zugelassen wurden und auf den Markt gekommen sind, basieren auf neuen Wirkstoffen. Das schreibt der Verband der forschenden Arzneimittelhersteller (VfA). Seit mindestens 25 Jahren sei das die höchste Anzahl. Damit habe die Pharmaforschung ihre „Produktivitätsdelle“ überwunden.
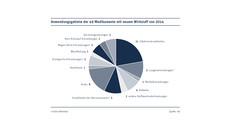
Zur Behandlung oder Prävention von Infektionskrankheiten gebe es elf neue Medikamente, darunter der Impfstoff Aflunov, die HIV-Präparate Tybost und Tivicay. Allein gegen Hepatitis C wurden laut VfA vier neue Medikamente zugelassen (Harvoni, Daklinza, Olysio, Sovaldi). Zudem gebe es zwei neue Antibiotika: Zevtera sowie das gegen den multiresistenten Klinikkeim MRSA aktive Vibativ. Zur Behandlung von Tuberkulose seien erstmals seit 1995 wieder neue Medikamente eingeführt worden (Sirturo, Deltyba); kombiniert mit älteren Mitteln bekämpfen sie multiresistente Erregerstämme, die sich unter anderem in Osteuropa ausbreiteten.
Gegen Krebs gibt es acht neue Präparate; normalerweise stehen diese zahlenmäßig an erster Stelle der Neueinführungen. Laut VfA richten sich die Neueinführungen gegen Lymphome (Sylvant), Schilddrüsenkrebs (Cometriq), Brustkrebs (Kadcyla) und Prostatakrebs (Xofigo, Provenge) sowie gegen die chronische lymphatische Leukämie – hier gebe es drei neue Medikamente (Imbruvica, Zydelig, Gazyvaro).
Jeweils fünf neue Wirkstoffe haben die Zulassung zur Behandlung von Krankheiten des Nervensystems (Tecfidera, Plegridy, Neuraceq, Latuda, Selincro) und der Lunge (Opsumit, Striverdi, Adempas, Anoro, Relva) erhalten. Im Bereich Diabetes gebe es vier neue Produkte (Eperzan, Invokana, Jardiance, Tresiba) und für Stoffwechselerkrankungen zwei neue Präparate (Vimizim, Glybera).
Jeweils drei neue Wirkstoffe stehen bei Gerinnungsstörungen (Voncento, NovoEight, Nuwiq), Magen-Darm-Erkrankungen (Revestive, Entyvio, Dexilant) und urologischen Erkrankungen (Velphoro, Spedra, Betmiga) zur Verfügung. Gegen Herz-Kreislauf-Erkrankungen (Simdax, Defitelio), Muskelerkrankungen (Translarna), zur Wundheilung (BioBag/BioMonde) und in der Anästhesie (Ampres) gibt es jeweils einen neuen Wirkstoff.
Neu wurde außerdem eine Gentherapie (Glybera) eingeführt – sie lindert den Lipoproteinlipase-Mangel, eine angeborene Fettstoffwechselkrankheit. Gegen einige Formen von Mukoviszidose und Muskeldystrophie gibt es dem VfA zufolge ebenfalls erstmals gezielt wirkende Arzneimittel.
Drei der neuen Medikamente dürften im Sinne der personalisierten Medizin erst verordnet werden, wenn ein Gentest die Eignung beim jeweiligen Patienten angezeigt hat (Kadcyla, Translarna, Imbruvica); ein weiteres Medikament wird individuell für jeden Kranken aus dessen eigenen Krebszellen zubereitet (Provenge).13 der 49 Medikamente mit neuen Wirkstoffen haben laut VfA den Status eines Orphan Drug, weil sie speziell für Menschen mit seltenen Krankheiten entwickelt wurden. Zu diesen Erkrankungen zählen erbliche Stoffwechsel- und Muskelkrankheiten, seltene Krebsarten, Tuberkulose und verschiedenen Formen von Lungenhochdruck.
Außerdem haben Hersteller zahlreiche bewährte Wirkstoffe in neuen Darreichungsformen herausgebracht, etwa um sie für weitere Krankheiten anwendbar zu machen. So ist nun ein Betablocker als Lösung einsetzbar gegen Blutschwamm bei Kindern (Wirkstoff: Propranolol). Zwei andere Wirkstoffe lassen sich jetzt unter die Haut spritzen, das spare den Patienten die bisher nötigen, lange dauernden Infusionen (MabThera, RoActemra).
An vier neuen Wirkstoffen (Jardiance, Striverdi Respimat, Adempas, Gazyvaro) hätten deutsche Labors von Pharmaunternehmen maßgeblich mitgewirkt; sie dienten der Behandlung von Leukämie, COPD, Diabetes und Lungenhochdruck. Die meisten neuen Medikamente wurden zudem unter Beteiligung deutscher Kliniken erprobt.
„Der enorme Forschungsaufwand muss sich aber für Patienten auszahlen und auch für die Firmen, damit sie die nächsten Innovationen finanzieren können“, sagt VfA-Hauptgeschäftsführerin Birgit Fischer.
Gelinge keine Verständigung über einen fairen Erstattungsbetrag, seien Hersteller mitunter gezwungen, Medikamente trotz Zulassung in Deutschland vom Markt zu nehmen, so Fischer. „Deshalb brauchen wir eine ganzheitliche Betrachtung des Innovationskreislaufs mit all seinen wissenschaftlichen wie wirtschaftlichen Dimensionen und Chancen; dabei setzen wir auf den laufenden Pharmadialog mit der Regierung“.
Der VfA vertritt 45 weltweit führende Hersteller und ihre mehr als 100 Tochter- und Schwesterfirmen. Die Mitglieder repräsentieren laut Angaben des Verbands rund zwei Drittel des deutschen Arzneimittelmarktes und beschäftigen in Deutschland mehr als 77.000 Mitarbeiter. 17.500 davon arbeiten in Forschung und Entwicklung.